中学受験:ややこしい中和反応の計算…基本3ステップで攻略せよ
中和問題の計算が難しい…基本知識と基本手順で攻略することができます
 こんにちは。かるび勉強部屋 ゆずぱ です。
こんにちは。かるび勉強部屋 ゆずぱ です。
今回のテーマは読者の方からリクエストが多かった 中和反応 。中和反応って、グラフの読み取りあり…表の読み取りあり…ちょっとした比例計算あり…で苦手意識を持つ子供も多い(-_-;) 攻略法は以下のとおり!
(1) 中和問題の基本7知識をおさえる
(2) 中和問題の手順3つのSTEPでとく
中和問題を攻略するのに必要な知識… たった7つの知識でほとんどの問題を攻略することができちゃいますd(^_^o) そして、解き方にも実は型(かた)があり、その型をベースに訓練すれば応用問題も対応可能です!
それでは、さっそく詳細にまいりましょう!
中和反応を理解する7つの基礎知識
中和反応の問題を理解するための基礎知識を7つにまとめました。応用問題を解くためにも必要な知識ですので、ひとつずつ着実におさえていきましょう!
知識① 中和とは… 酸性+アルカリ性→中性
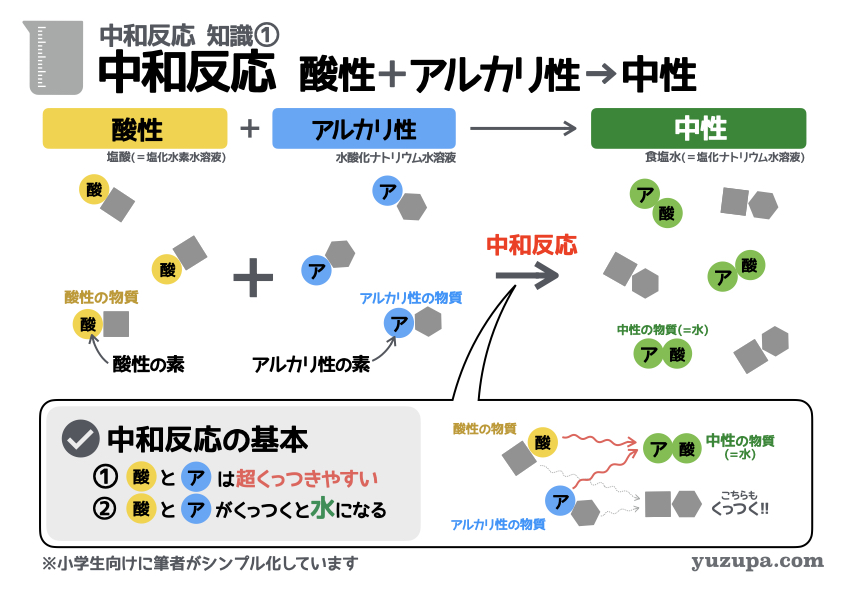
最初の知識は「中和反応とは何か?」についてです。
中和反応をザックリと表現すると…
酸性の液体 と アルカリ性の液体 混ぜると 中性の液体 になる!
とてもシンプルですが、いくつかの補足知識が必要になります。
酸性の物質には「酸性の素」が含まれており、アルカリ性の物質には「アルカリ性の素」が含まれています。そして大事な中和反応の基本が2つあります。
① 「酸性の素」と「アルカリ性の素」は超くっつきやすい!
② 「酸性の素」と「アルカリ性の素」がくっつくと「水」になる!
これが中和反応の具体的なイメージです。
そしてもうひとつ、実際の入試問題向けにおさせておくべきこと。それは酸性の液体とアルカリ性の液体の代表選手をおさえておくということですd(^_^o)
代表選手
酸性の液体 :塩酸 (塩化水素水溶液)
アルカリ性の液体 :水酸化ナトリウム水溶液
中和した後の液体 :食塩水 (塩化ナトリウム水溶液)
実際の問題も、塩酸と水酸化ナトリウム水溶液で出題されることが多いので、まずは、この代表選手で中和反応を理解できるようにしましょう!
知識② 酸性とアルカリ性 3つのバランス
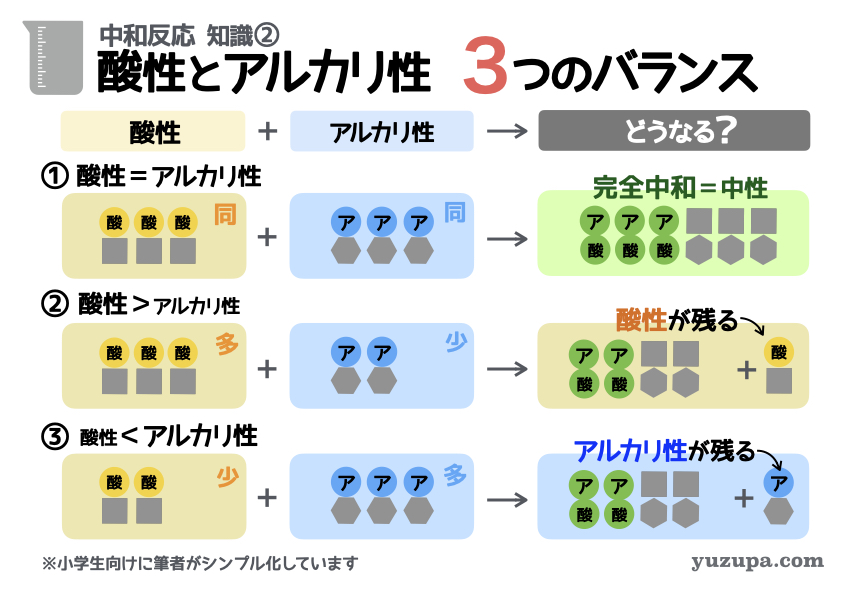
中和反応の具体的なイメージができたら、次は酸性とアルカリ性のバランスについてです。3つのバランスをおさえましょう!
① 酸性=アルカリ性
コレは「酸性の素」と「アルカリ性の素」の数が全く同じ場合。数が同なので、当然すべての「酸性の素」と「アルカリ性の素」がくっついて「水」になります。これを「完全中和」といって、最終的な液体も中性 になりますd(^_^o)
② 酸性>アルカリ性
コレは「酸性の素」の数が「アルカリ性の素」の数より多い場合。「酸性の素」と「アルカリ性の素」がくっついて「水」になりますが、「酸性の素」がちょっと余っちゃいます。最終的な液体は酸性 になりますd(^_^o)
③ 酸性<アルカリ性
最後は「酸性の素」の数が「アルカリ性の素」の数より少ない場合。「酸性の素」と「アルカリ性の素」がくっついて「水」になりますが、「アルカリ性の素」がちょっと余っちゃいます。最終的な液体はアルカリ性 になりますd(^_^o)
こんな感じで「酸性の素」と「アルカリ性の素」の数
そのバランスが3パターンあることをおさえましょう!
知識③ 水溶液を蒸発させると残るモノ
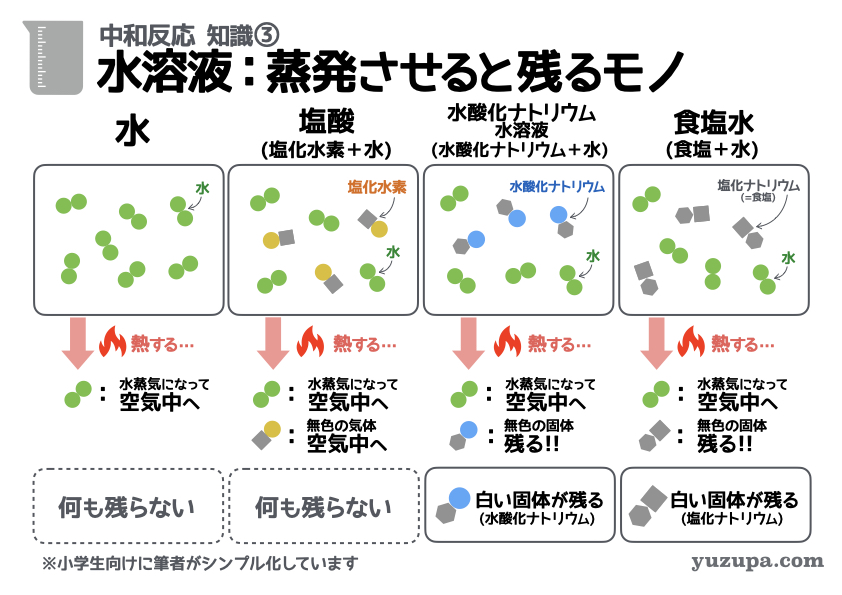
中和反応の3つ目の基本知識です。
3つ目の基本知識は…中和反応の問題によく出題される液体たちを 加熱して蒸発させたらどうなるか?というモノ。いままで登場した4つの液体を蒸発させるとどうなるか、それぞれ見ていきましょう!
(1) 水を蒸発させると?
まずは水です。水は加熱すると100度くらいで水蒸気になります。水蒸気になると空気注に飛んでいってしまいます。ですので、水を蒸発させると…そこには何ものこりません∑(゚Д゚)
(2) 塩酸を蒸発させると?
つぎは塩酸です。塩酸というのは、塩化水素という気体と水で構成されています∑(゚Д゚) なので別名を塩化水素水溶液なんて呼んだりします。この塩酸を加熱して蒸発させたらどうなるでしょうか?
水はさきほどお伝えしたとおり、水蒸気になって空気中に飛んでいきます。そして塩化水素ももともと気体ですので、そのまま空気中に飛んでいっちゃいます。結果として、塩酸を蒸発させると…何ものこりません (^_^;)
(3) 水酸化ナトリウム水溶液 を蒸発させると?
次は水酸化ナトリウム水溶液。水酸化ナトリウム水溶液は、水酸化ナトリウムという白い固体と水で構成されています_φ(・_・ ◯◯水溶液 っていうのは、◯◯が溶けた水という意味。名前からも想像できますねd(^_^o)
これを加熱すると、水は同じく水蒸気になって空気中に飛んでいきますが、水酸化ナトリウムは白い固体。水だけがなくなり、白い固体だけが残ります。
(4) 食塩水を蒸発させると?
最後は食塩水です。食塩水はみなさんもご存知のとおり、食塩と水で構成されています。ちなみに食塩の別名は塩化ナトリウム。ですので、食塩水は塩化ナトリウム水溶液なんて呼ばれ方もします¥_φ(・_・
これを加熱すると、水は水蒸気になって空気中に飛んでいきます。そして食塩は白い固体。水だけがなくなり、白い固体だけが残ります。
中和反応で登場するメジャーな4つの液体。それぞれ蒸発させるとどうなるか?超重要な知識ですので、しっかりおさえましょうo(^-^)o
① 水 → なにも残らない
② 塩酸 → なにも残らない
③ 水酸化ナトリウム水溶液 → 白い固体が残る
④ 食塩水 → 白い固体が残る
水溶液を熱するとどうなるか? については以下の解説もご参照ください!
水溶液へのリンク
知識④ 超重要な3つの数字セット
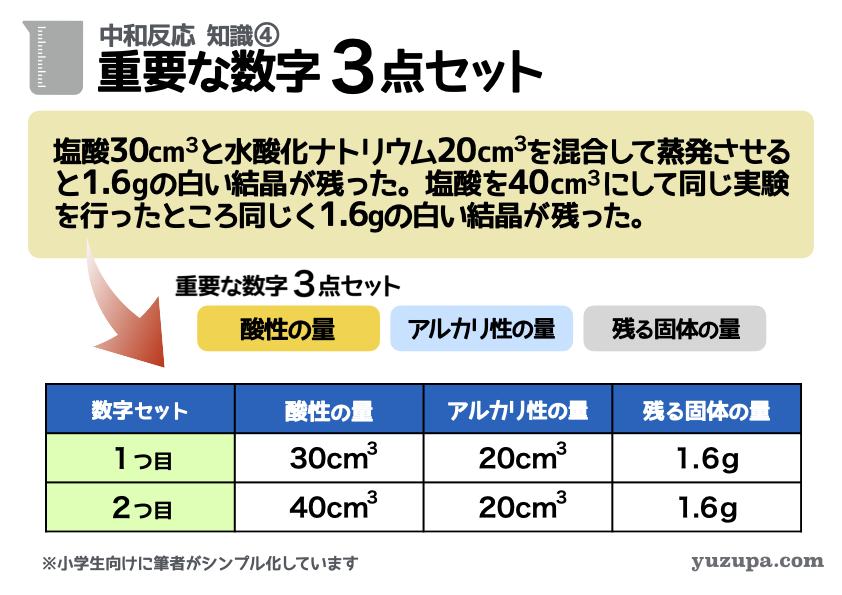
中和反応で必要な7つの基本知識。つぎは重要な3つの値です。
中和反応の問題では…常にこの3つの値を追うことになります。
重要な数字3点セット
(1) 酸性の液体の量
(2) アルカリ性の液体の量
(3) 蒸発させたとき残る固体の量
上記の問題文を読んでみましょう。問題文にはこの重要な3つの数字が登場しますが セットでおさえることが超重要 です。この問題文の場合は、問題文から3つの重要な数字を2セット取り出すことができますねd(^_^o)
知識⑤ 液体の混ぜ方3つのパターン
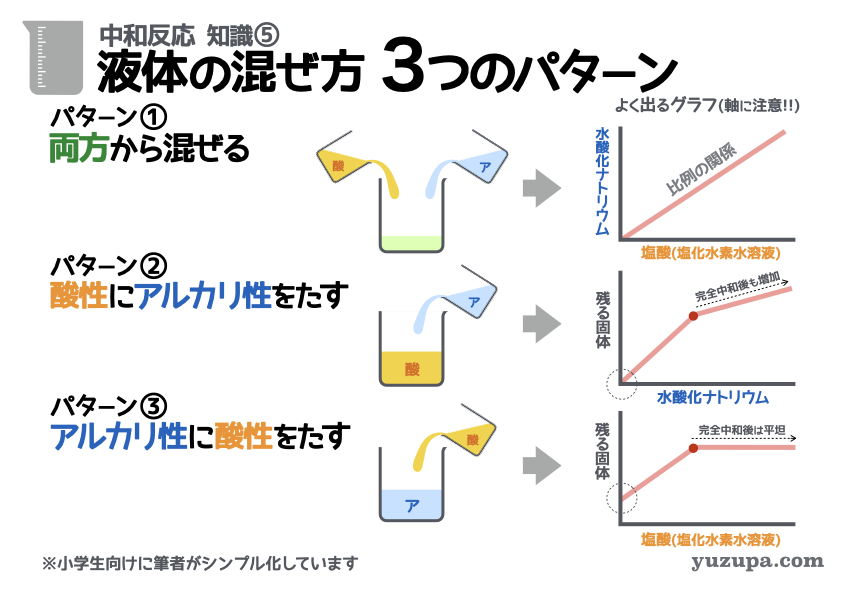
中和反応5つ目の基本知識は液体の混ぜ方についてです。大きく分けて3つの混ぜ方があるので、この3つのパターンをおさえましょう!
パターン① 両方から混ぜる
酸性の液体とアルカリ性の液体を図のように、いろんな量ずつ混ぜるというやり方です。このパターンの時によくでるグラフがあります。縦軸にアルカリ性の液体、横軸に酸性の液体の量をとり完全中和をする時の量を表したグラフです。
完全中和は「酸性の素」の数と「アルカリ性の素」の数が等しいとき
ですので図に示すような比例関係のグラフになります
※ 縦軸と横軸が反対になっていることもあるので注意_φ(・_・
パターン② 酸性にアルカリ性をたす
酸性の液体にアルカリ性の液体を図のように、少しずつたしていくというやり方です。このパターンでよくでるグラフは縦軸に蒸発させた時の固体の量、横軸にアルカリ性の液体(たした量)が取られるグラフです。
グラフの特徴がるのですが6つ目の知識で詳しく説明します_φ(・_・
パターン③ アルカリ性に酸性性をたす
アルカリ性の液体に酸性の液体を図のように、少しずつたしていくというやり方です。このパターンでよくでるグラフは縦軸に蒸発させた時の固体の量、横軸に酸性の液体(たした量)が取られるグラフです。
こちらもグラフの特徴は6つ目の知識で詳しく説明します_φ(・_・
知識⑥ 頻出 3つのグラフと表
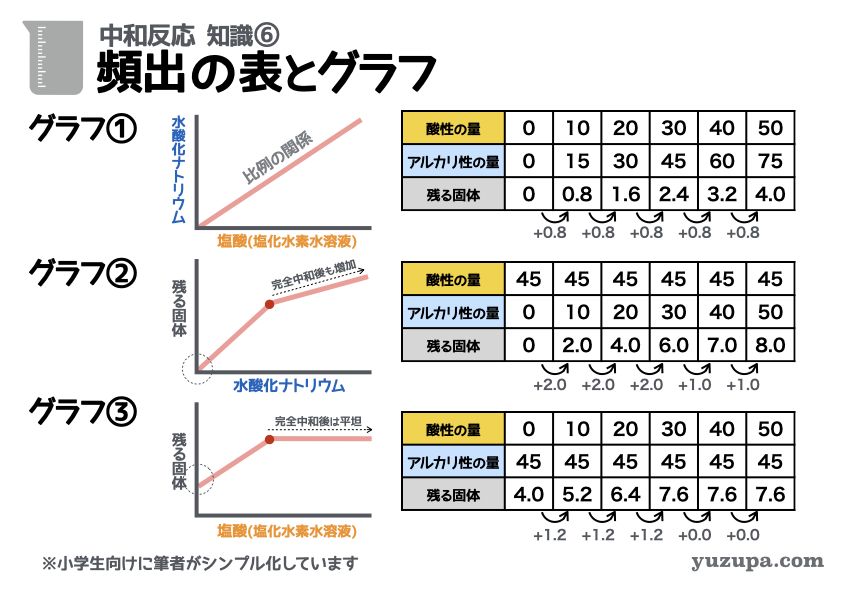
5つ目の知識でご紹介した3つの混ぜ方。それぞれによく出されるグラフと表があるので、その特徴をシッカリおさえましょう!
グラフ① 両方から混ぜる
縦軸にアルカリ性の液体、横軸に酸性の液体の量をとり完全中和をする時の量を表したグラフです。5つ目の知識でもお伝えしたとおり、完全に比例関係のグラフになります。その理由はとてもシンプルです。
完全中和は「酸性の素」と「アルカリ性の素」が同じ数のとき
酸性の液体の量が増えれば、アルカリ性の液体の量も増えるという関係
注意が必要なのは、入試に出てくるグラフの軸の単位は体積(㎤)だったり、重さ(g)だったりするということ。酸性の液体20gとアルカリ性の液体30gが完全中和したりします。ただ比例関係であることは変わりません!
※ 縦軸と横軸が反対になっていることもあるので注意_φ(・_・
パターン② 酸性にアルカリ性をたす
縦軸に蒸発させた時の固体の量、横軸にアルカリ性の液体(たした量)が取られるグラフです。グラフを見る上で3つのポイントがあります。
(1) スタート時は塩酸だけなので蒸発させても何ものこらない
つまりグラフのスタートは「残る固体の量=ゼロ」からはじまります
(2) 完全中和のするまで、残る固体がちょっとずつ増え続けます
これは中和すればするほど食塩ができるからです
(3) 完全中和のあとも、残る固体がちょっとずつ増え続けます
水酸化ナトリウム水溶液をたすので、たした分だけ残る固体が増えます
パターン③ アルカリ性に酸性性をたす
縦軸に蒸発させた時の固体の量、横軸に酸性の液体(たした量)が取られるグラフです。同じくグラフを見る上で重要なポイントは3つです。
(1) スタート時は水酸化ナトリウム水溶液だけ蒸発させると固体が残ります
つまりグラフのスタートは「残る固体の量=ゼロ」ではありません
(2) 完全中和のするまで、残る固体がちょっとずつ増え続けます
これは中和すればするほど食塩ができるからです
(3) 完全中和のあとは、残る固体は一定になります
塩酸をたすので、いくらたしても残る固体は増えません
いかがでしょうか?この3つのグラフとそれに対応する3つの表を理解することができれば、中和問題の攻略はすぐそこですd(^_^o)
知識⑦ 性質を調べる5つの指示薬

最後の知識は指示薬について。
ここで出てくる指示薬とは・・・酸性やアルカリ性や中性を調べることができる薬のことです。中学受験では5つの指示薬をおさえましょうd(^_^o)
特に頻出はBTB溶液・・・色を着実におさえましょう
指示薬についての詳細は以下の解説をご参照ください!
指示薬へのリンク
中和反応の計算を攻略する3ステップ

中和反応問題を攻略するための実践力をつけるため、基本的な問題の解き方の型(かた)の解説にうつりますd(^_^o)
基本的には3つのステップで問題を解くことができます。
STEP1 : 重要数字セットを読み取る
ひとつ目のステップは重要数字のセットを読み取るということ。重要数字のセットとは何だったでしょうか? 基本知識の4つ目にご紹介した数字です。
重要な数字3点セット
(1) 酸性の液体の量
(2) アルカリ性の液体の量
(3) 蒸発させたとき残る固体の量
問題文や表やグラフからこれら3つの数字を読み取ります。これら3つの数字を読み取ろうとするとき、以下のことを意識しましょう!
数字を見つける時のポイント
① 混ぜ方はどのパターンなのか?
② 残る固体の量の変化はどうなっていくのか?
③ 3つセットで読み取れる場所があるか?
この3つの視点を意識しながら問題文を読んだり、グラフや表を分析すると、問題を一気に解きやすくなります。
次の項の実際の問題演習でより詳しく説明しますo(^-^)o
STEP2 : 完全中和の比を見きわめよ
ふたつ目のステップは完全中和の比を見きわめるという作業。このステップをやらなくても解けちゃう問題はあるのですが、中和反応のキモですので、仮に不要であってもこのステップは意識しましょう!
STEP3 : 比例計算で答えを出す!
最後のステップは比例計算をします。答えを出すのに最後は比例計算が必要になります。表やグラフから読み取れてしまう問題もありますが、表やグラフ外にある値は、比例計算をしてあげる必要がありますd(^_^o)
ステップを見ただけだとイメージが湧かないと思います。6つの例題を準備しましたので、その問題を使って具体的に3ステップをおぼえましょう!
中和反応の問題事例6題
中和する量を求める問題 (1)
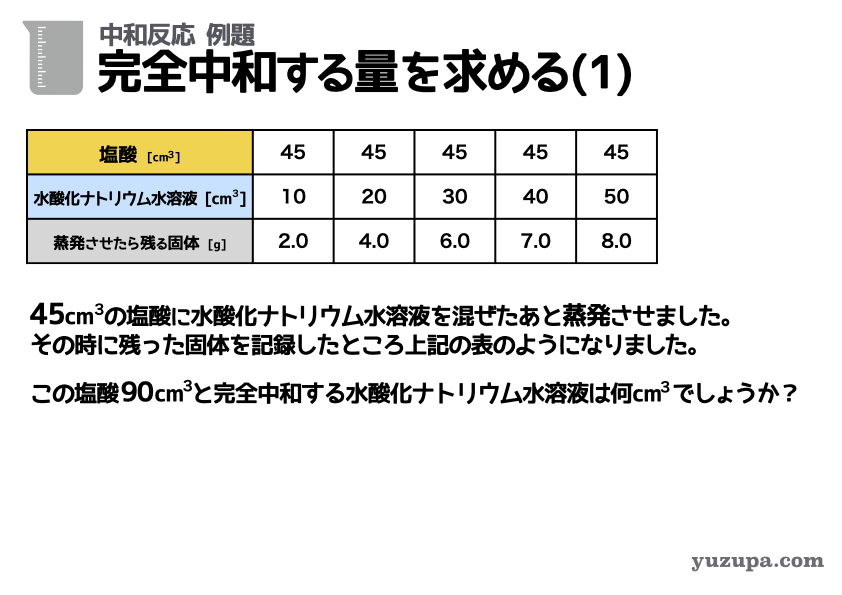
最初の例題は王道中の王道。完全中和するために必要な液体の量を求めるという問題です。前項でご紹介した3ステップに移りましょう!
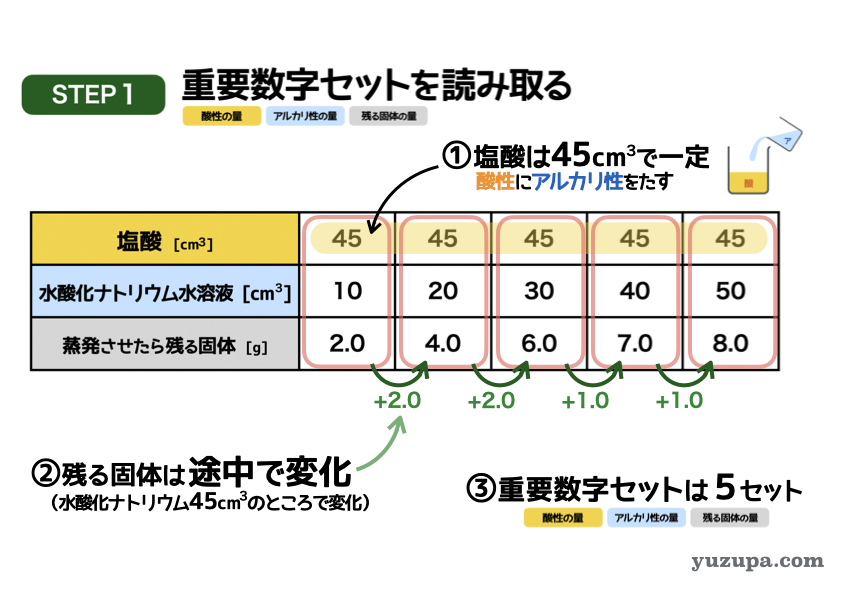
最初のステップは重要数字を読み取るでした。この表を見るだけで多くのことがわかります。
① 塩酸の量はずっと45㎤で一定ですので混ぜ方は「酸性にアルカリ性をたす」パターンであることが分かります。
② 蒸発時に残る固体。最初は2gずつ増えていますが、途中から1gずつ増えるという形に・・・。パターンどおりですね!
③ 3つセットで数字が読み取れるところはあるか?この問題の場合、5セットも3つの数字がセットでとれそうです!
表の分析がおわったところで、いよいよ2つ目のステップです。
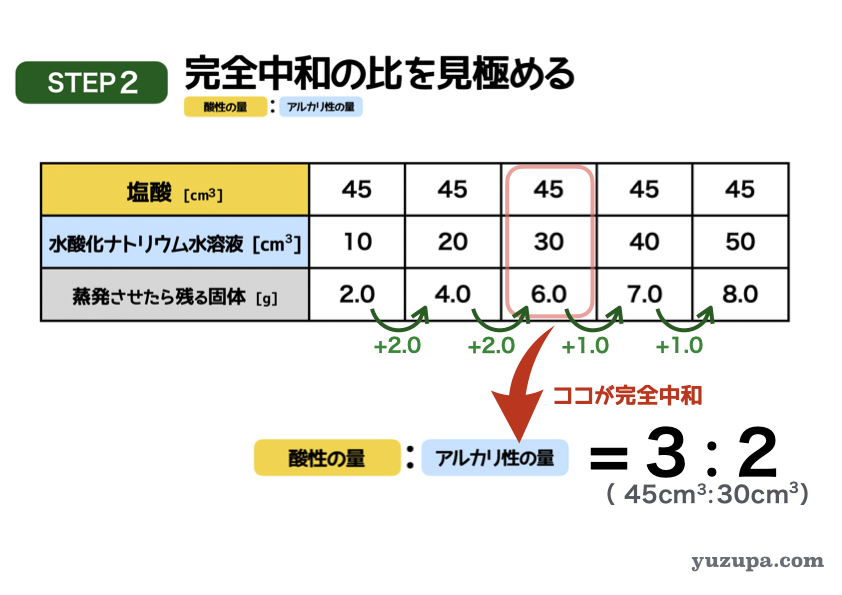
このステップでは完全中和の比率を見きわめます。
この表で完全中和になっているポイントはどこでしょうか?蒸発時に残る固体の増え方が変わるところです!この完全中和ポイントで酸性の液体とアルカリ性の液体の比がどうなっているか見きわめましょう。
このポイントを読み取ると・・・
塩酸の量=45㎤、水酸化ナトリウム水溶液=30㎤、残る固体=6.0g です。
こちらにあるとおり 3:2 になっていますね!
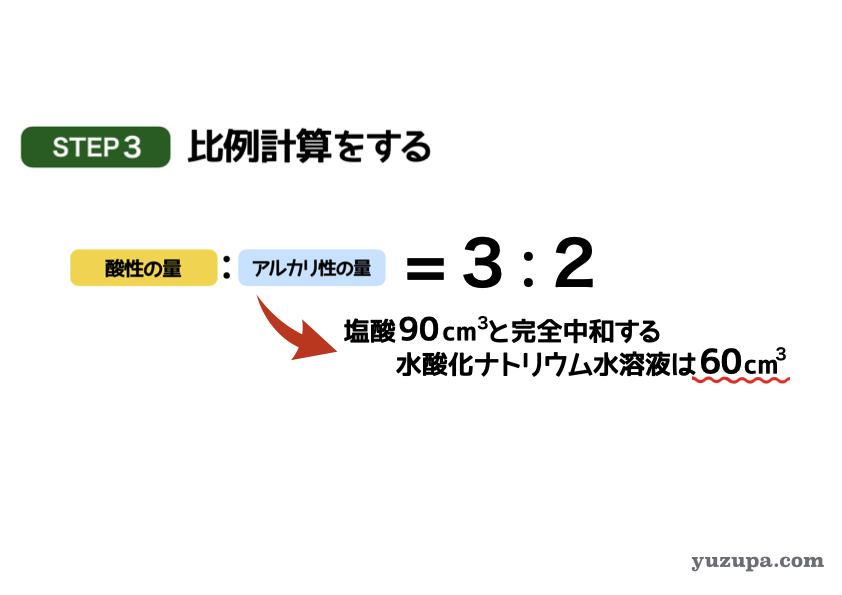
最後のステップで問題が求める答えに迫ります。
問題文では塩酸90㎤と完全中和する水酸化ナトリウム水溶液の量を求めていますので、比例計算でもとめましょう!酸性:アルカリ性が3:2ですので、必要な水酸化ナトリウム水溶液は60㎤であることがわかります。
答えは 60㎤ です
中和する量を求める問題 (2)
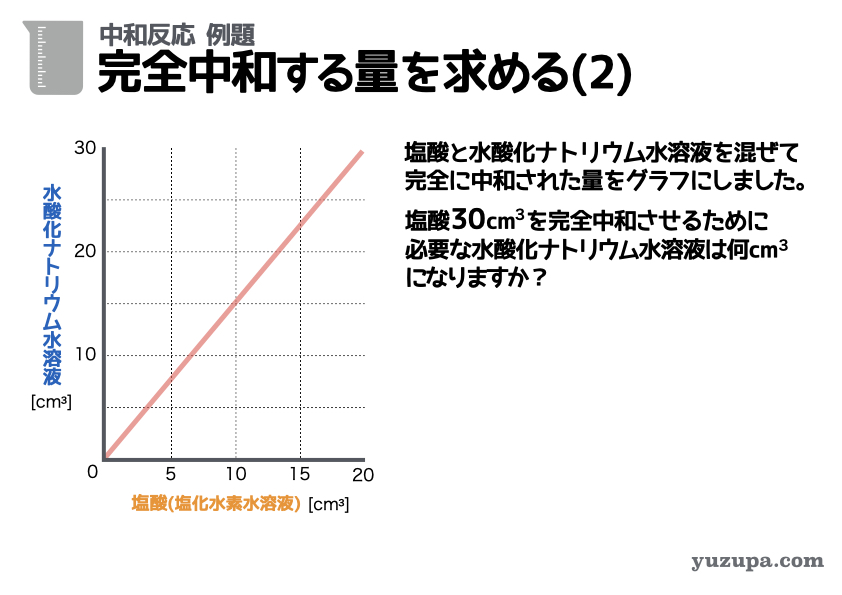
もう1問、王道中の王道問題をやっておきましょう。今度は表ではなくグラフが情報の入手源ですd(^_^o)
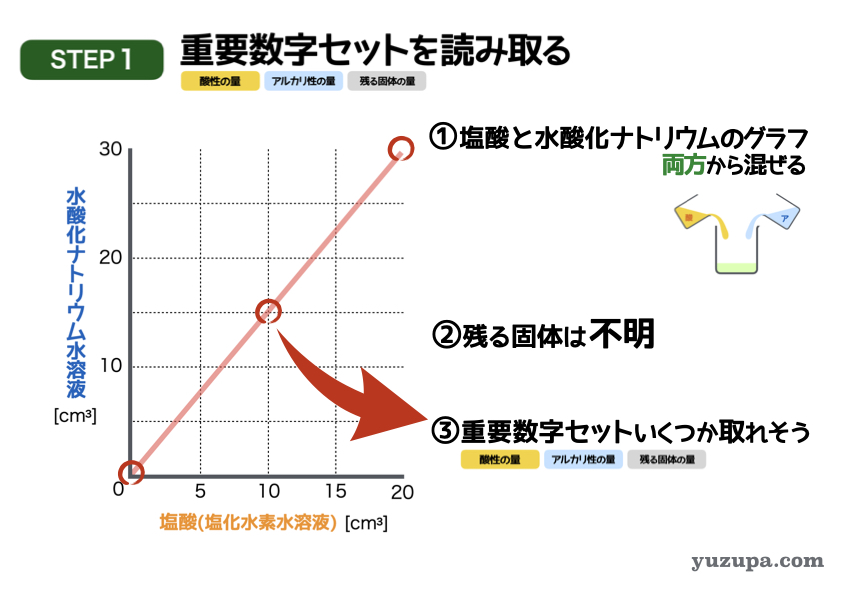
最初のステップでは重要数字を読み取ります。今度は表ではなくグラフです。
① 塩酸の量と水酸化ナトリウム水溶液の量を軸にとったグラフ。両方とも量が変わりますので、混ぜ方は両方から混ぜるパターンですね。
② 蒸発時に残る固体。あれ・・・見当たらない。この問題では読み取ることができません。こういう問題も存在しますので慌てずに!
③ 3つセットで数字が読み取れるところはあるか?グラフの場合は、グラフの目盛とピッタリのところを探すのが鉄則。何ヶ所かありそうです!
グラフの分析がおわったら、2つ目のステップにまいりましょう。
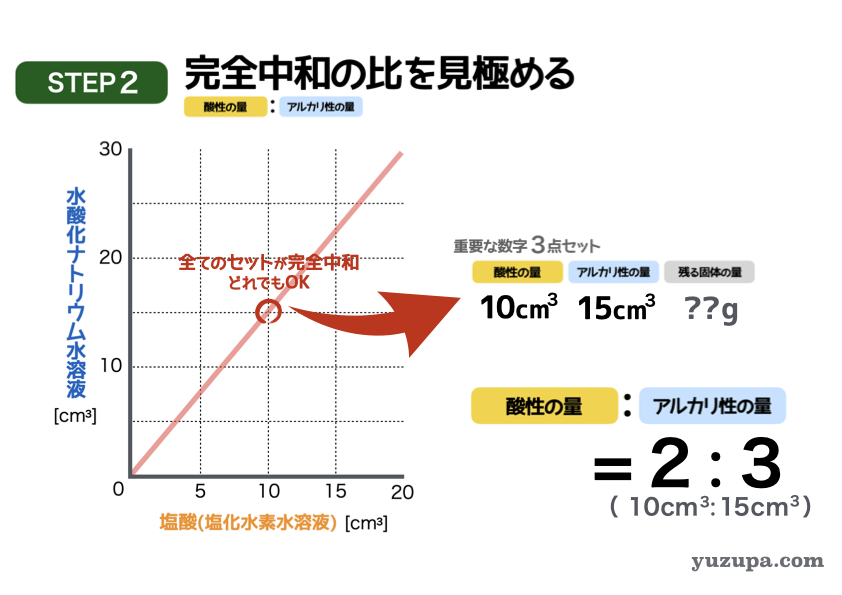
このステップでは完全中和の比率を見きわめます。
この表で完全中和になっているポイントはどこでしょうか?このグラフは完全中和する量を記録したグラフですので、読み取れるところであれば、どこでもOKです!この真ん中にあるポイントを使いましょう。
このポイントを読み取ると・・・
塩酸の量=10㎤、水酸化ナトリウム水溶液=15㎤ です。
簡単な比にすると2:3 にります!
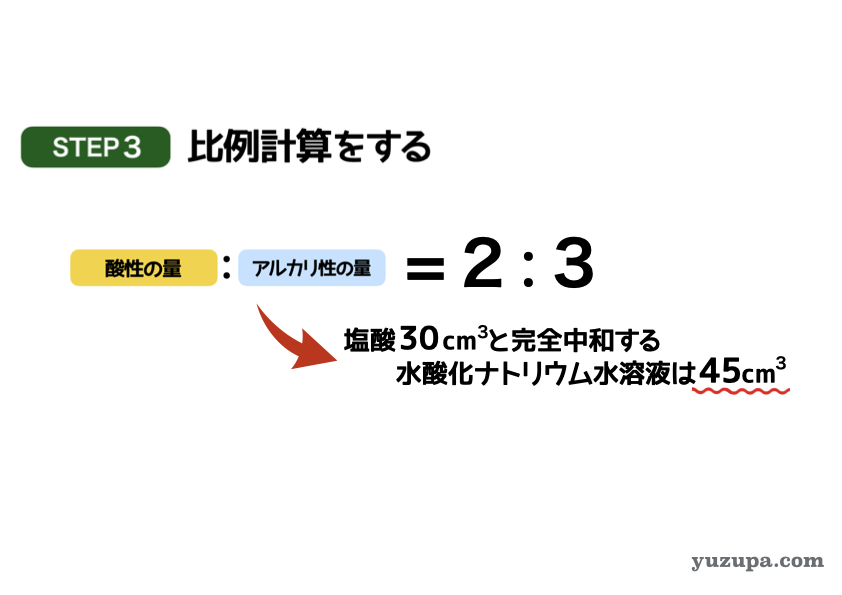
最後のステップでいよいよ答えを計算します。
問題文では塩酸30㎤と完全中和する水酸化ナトリウム水溶液の量を求めていますので、比例計算でもとめます。酸性:アルカリ性が2:3ですので、必要な水酸化ナトリウム水溶液は45㎤であることがわかります。
答えは 45㎤ です
液体の性質を求める問題 (1)

つぎは液体の性質(酸性か中性かアルカリ性か)を求める問題です。
知識②の3つのバランス や 知識⑦の指示薬の知識 などが必要になります。
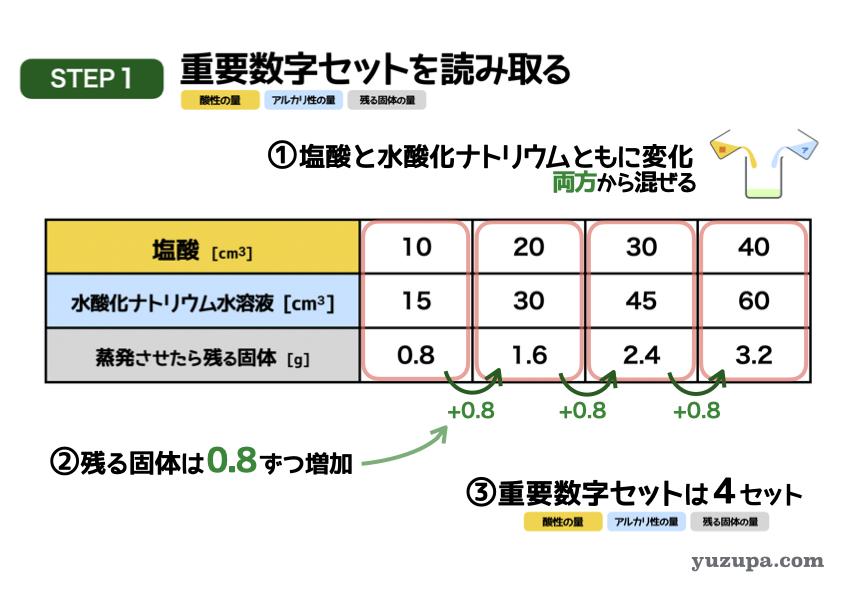
最初のステップでは重要数字を読み取ります。今度は表ですねd(^_^o)
① 塩酸の量と水酸化ナトリウム水溶液の量がどちらも一定ではないので、両方から混ぜるパターンであることが分かります。
② 蒸発時に残る固体。これは表にダイレクトに書かれていますが、隣の列と差を取ってみると0.8gずつ増加していることがわかりますね!
③ 3つセットで数字が読み取れるところはあるか?この表の場合は、すべて3点セットがそろっていますo(^-^)o
表の分析がおわりました。2つ目のステップにまいりましょう。

このステップでは完全中和の比率を見きわめます。
この表で完全中和になっているポイントはどこでしょうか?この表は完全中和する量を記録した表ですので、読み取れるところであれば、どこでもOKです!計算しやすそうな左から2番目のセットを使いましょう。
このポイントを読み取ると・・・
塩酸の量=20㎤、水酸化ナトリウム水溶液=30㎤、残る固体=1.6g
簡単な比にすると2:3 にります!
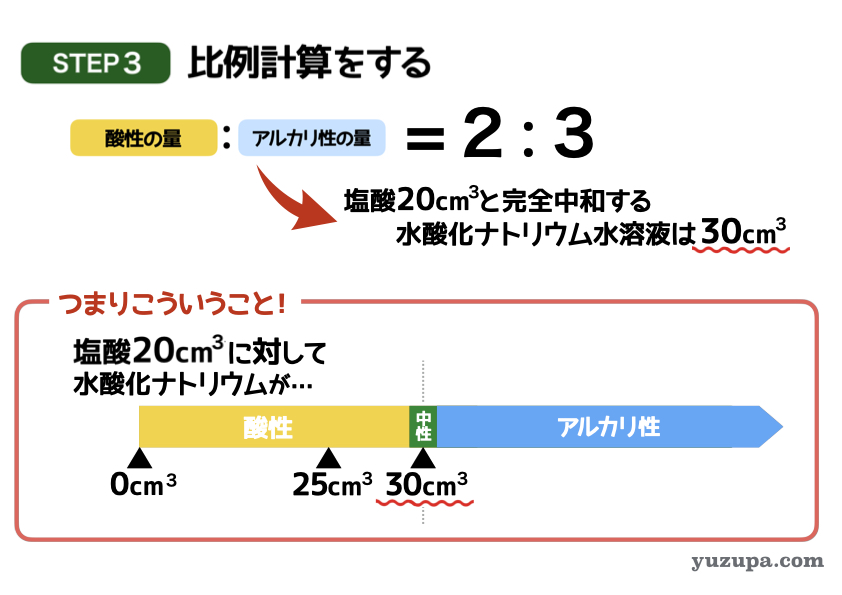
最後のステップでいよいよ答えを計算します。
問題文では塩酸20㎤と水酸化ナトリウム水溶液25㎤を混ぜると何性になるかを求めています。まずは塩酸20㎤と完全中和する水酸化ナトリウムの量を求めると…比例計算で30㎤であることが分かります。
つまり…塩酸20㎤に対して水酸化ナトリウム水溶液が 30㎤より少ない時は酸性、多いときはアルカリ性 になるということ。
水酸化ナトリウム水溶液が25㎤であれば酸性ですねd(^_^o)
酸性のとき、BTB溶液は黄色を示しますので
答えは 黄色 です
液体の性質を求める問題 (2)
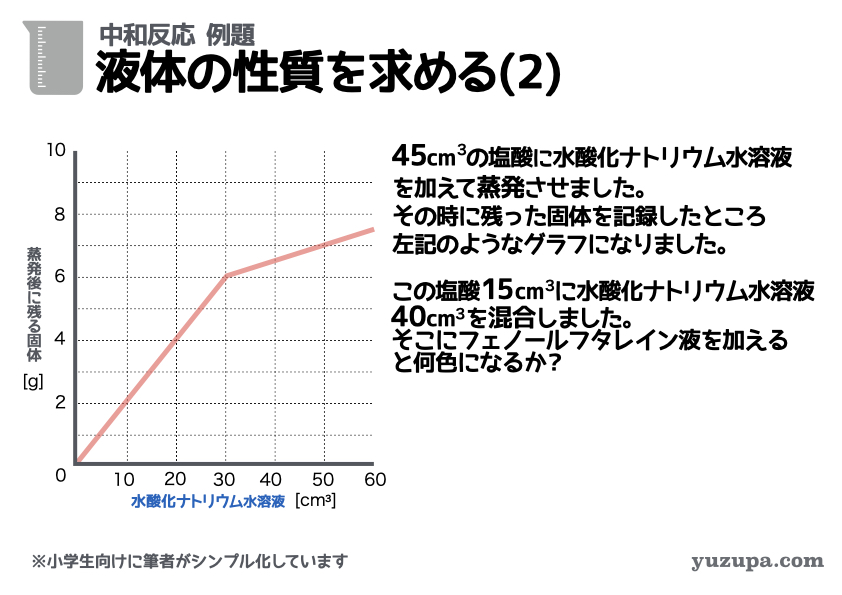
液体の性質(酸性か中性かアルカリ性か)を求める問題をもう1問!
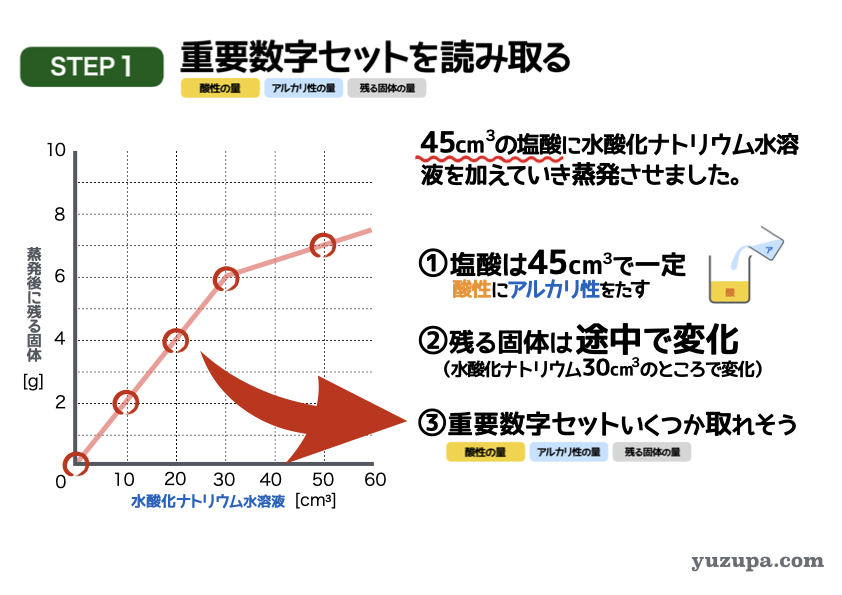
最初のステップでは重要数字を読み取ります。今度はグラフですd(^_^o)
① 塩酸の量はずっと45㎤で一定ですので混ぜ方は「酸性にアルカリ性をたす」パターンであることが分かります。
② 蒸発時に残る固体。グラフが途中で折れて(増え方が変化して)います。水酸化ナトリウムが30㎤のところで変化があるようです。
③ 3つセットで数字が読み取れるところはあるか?このグラフの場合は、けっこう大量に読み取れるポイントがありますねo(^-^)o
グラフの分析がおわりました。2つ目のステップにまいりましょう。
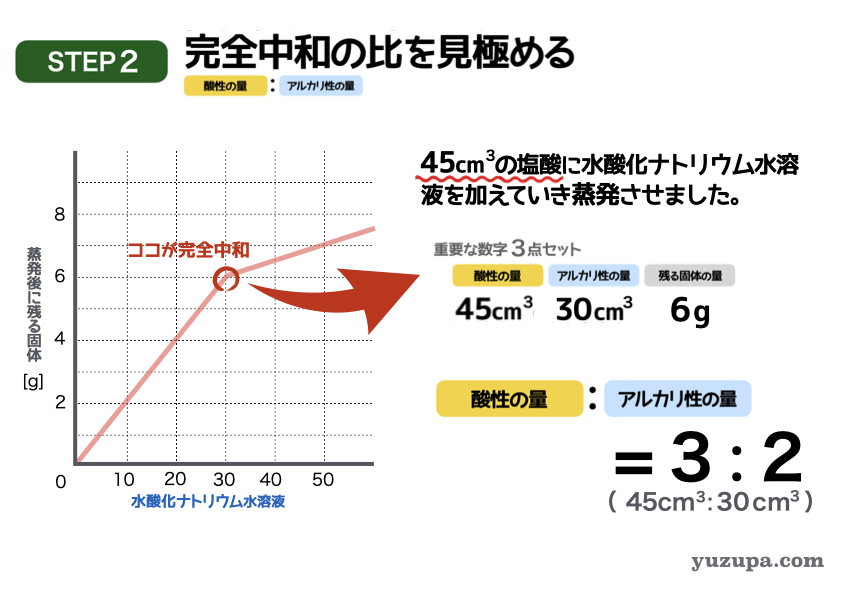
このステップでは完全中和の比率を見きわめます。
このグラフで完全中和になっているポイントはどこでしょうか?このグラフの場合は、グラフが折れ曲がっているところです。ここで完全中和に達し、それ以降は水酸化ナトリウムだけが増えている状態ですねd(^_^o)
このポイントを読み取ると・・・
塩酸の量=45㎤、水酸化ナトリウム水溶液=30㎤、残る固体= 6g
簡単な比にすると3:2 にります!
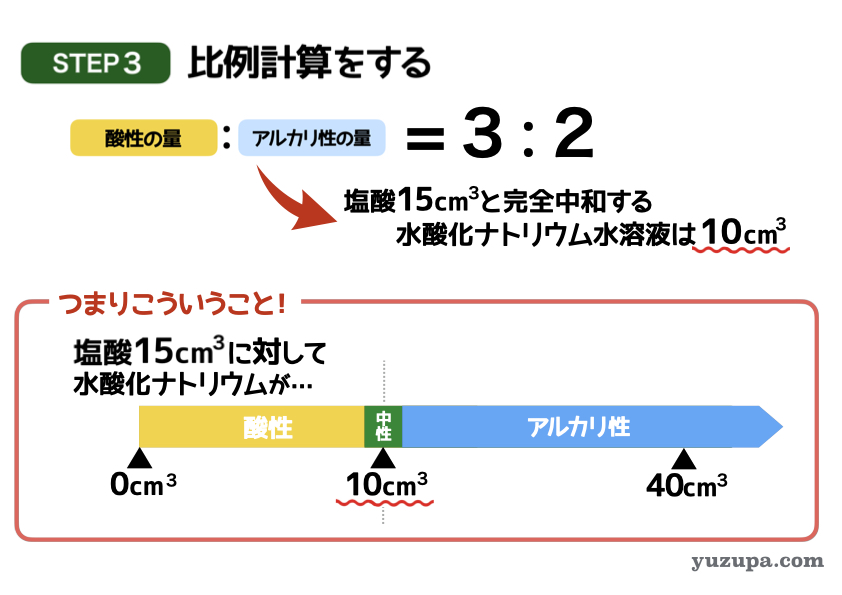
最後のステップで答えを計算します。
問題文では塩酸15㎤と水酸化ナトリウム水溶液40㎤を混ぜると何性になるかを求めています。まずは塩酸15㎤と完全中和する水酸化ナトリウムの量を求めると…比例計算で10㎤であることが分かります。
つまり… 塩酸10㎤に対して水酸化ナトリウム水溶液が 10㎤より少ない時は酸性、多いときはアルカリ性 になるということ。
水酸化ナトリウム水溶液が40㎤であればアルカリ性ですねd(^_^o)
アルカリ性のときフェノールフタレインは赤色を示しますので
答えは 赤色 です
固体の量を求める問題 (1)

今度は重要な3つの数字のうち「残る固体」を求める系の問題です。
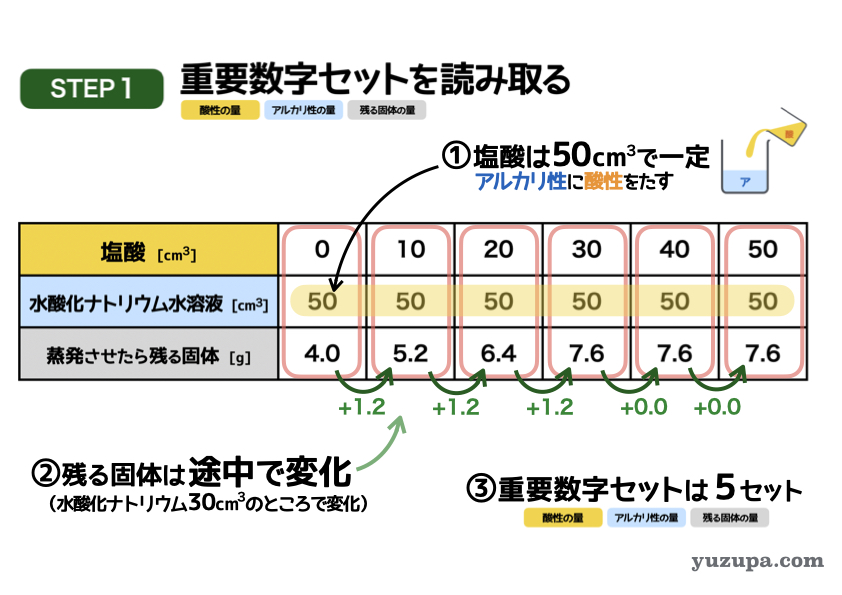
最初のステップでは重要数字を読み取ります。今度は表ですd(^_^o)
① 水酸化ナトリウム水溶液の量がずっと50㎤で一定ですので混ぜ方は「アルカリ性に酸性をたす」パターンですねo(^-^)o
② 蒸発時に残る固体。途中までは1.2gずつ増加し、その後は7.6gで一定であることが読み取れますね。
③ 3つセットで数字が読み取れるところはあるか?この表もすべての列で3つセットで数字を読み取ることができます_φ(・_・
表の分析がおわりました。2つ目のステップにまいりましょう。
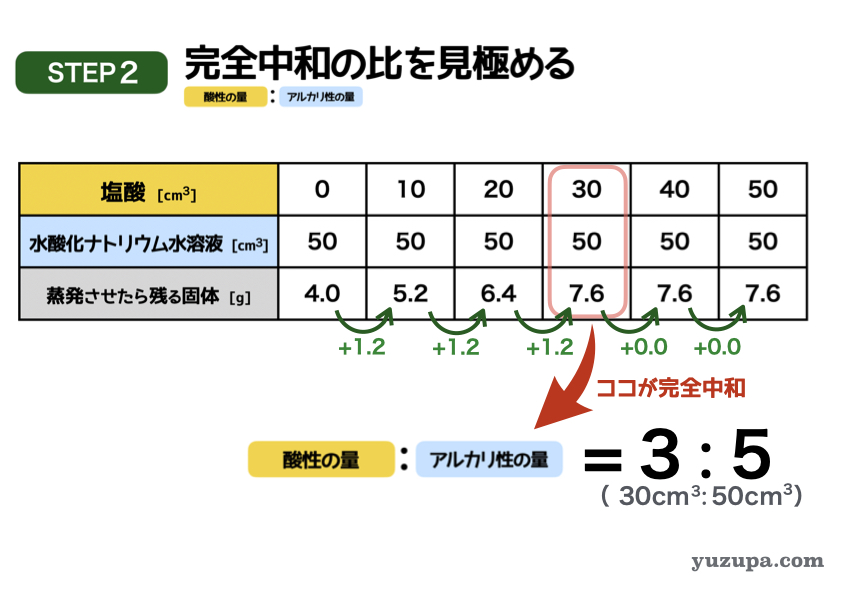
このステップでは完全中和の比率を見きわめます。
ただしこの問題の場合、完全中和の比は使わなくても解けちゃいます(^_^;)
中和反応では重要なポイントですのでここでは求めておきます
この表で完全中和になっているポイントはどこでしょうか?増加の仕方が変化しているところです。塩酸が30㎤のところです。それ以降は塩酸がたされるだけですので、いくらたしても残る固体の量は変わりませんね。
このポイントを読み取ると・・・
塩酸の量=30㎤、水酸化ナトリウム水溶液=50㎤、残る固体= 7.6g
簡単な比にすると3:5 にります!
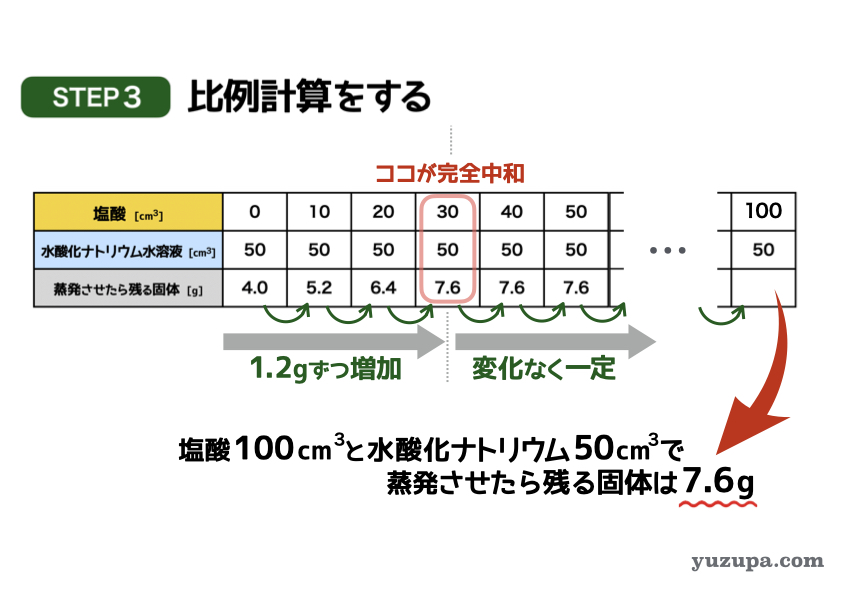
最後のステップで答えを計算します。
問題文では塩酸100㎤を混ぜて蒸発させると何gの固体が残るかを求めています。表を右に延長して比例計算をしてみましょう。
あれ…これは「アルカリ性に酸性をたす」パターンなので、いくら塩酸をたしても残る固体の量には変化がない!塩酸を100㎤たそうが、1000㎤たそうが残る固体は7.6gのままとなることがわかりますd(^_^o)
答えは 7.6g です
固体の量を求める問題 (2)
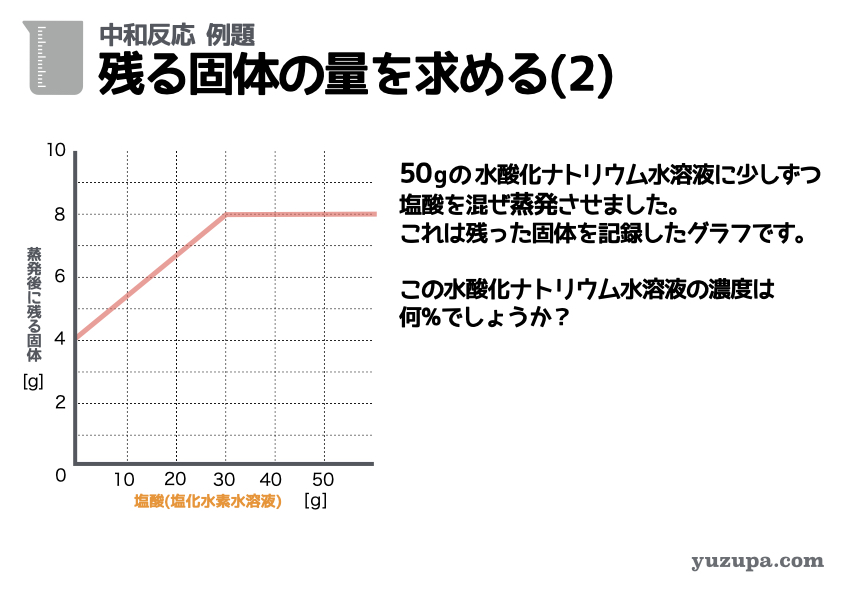
例題の最後です残る固体を求める系の問題をもう1問です。
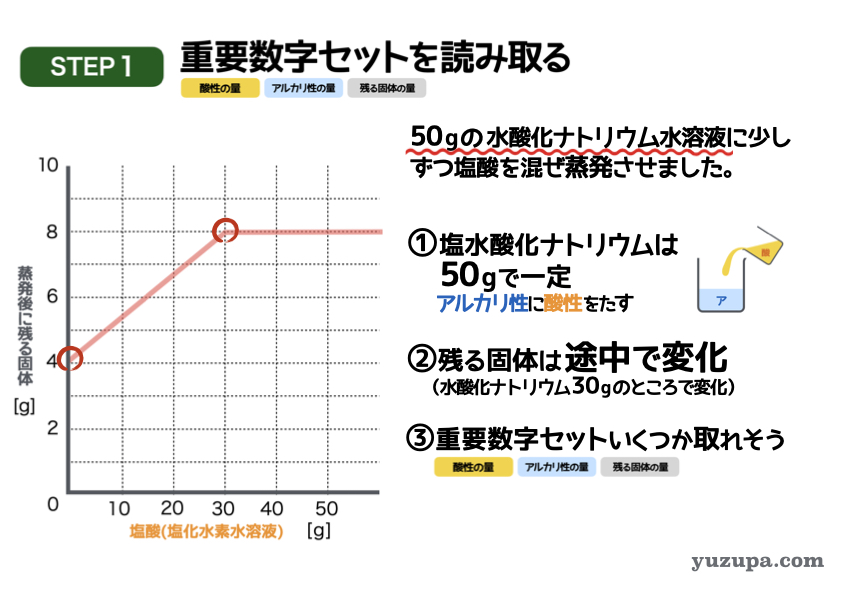
最初のステップでは重要数字を読み取ります。今度はグラフですd(^_^o)
① 水酸化ナトリウム水溶液の量がずっと50 gで一定ですので混ぜ方は「アルカリ性に酸性をたす」パターンですねo(^-^)o
② 蒸発時に残る固体。最初は4.0gからはじまり途中までは増加し、その後は8.0gで一定になることが読み取れますね。
③ 3つセットで数字が読み取れるところはあるか?このグラフの場合、グラフの目盛りとぴったりで読めそうなところが2点くらいでしょうか_φ(・_・
グラフの分析がおわりました。2つ目のステップにまいりましょう。
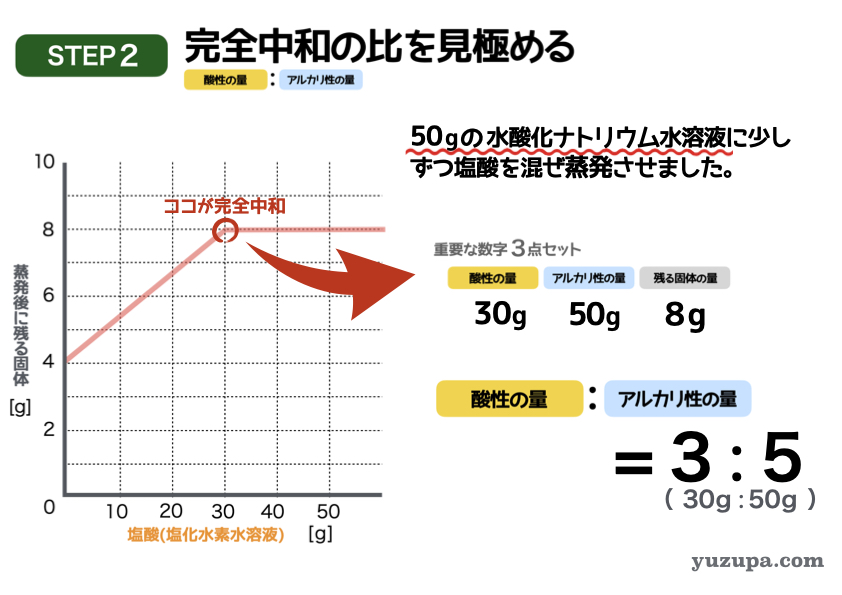
このステップでは完全中和の比率を見きわめます。
この問題の場合も、完全中和の比は使わなくても解けちゃいます(^_^;)
同様に中和反応では重要なポイントですのでここでは求めておきます
この表で完全中和になっているポイントはどこでしょうか?増加の仕方が変化しグラフが折れているところです。塩酸が30gのところです。それ以降は塩酸がたされるだけですので、いくらたしても残る固体の量は変わりませんね。
このポイントを読み取ると・・・
塩酸の量=30g、水酸化ナトリウム水溶液=50g、残る固体= 8.0g
簡単な比にすると3:5 にります!
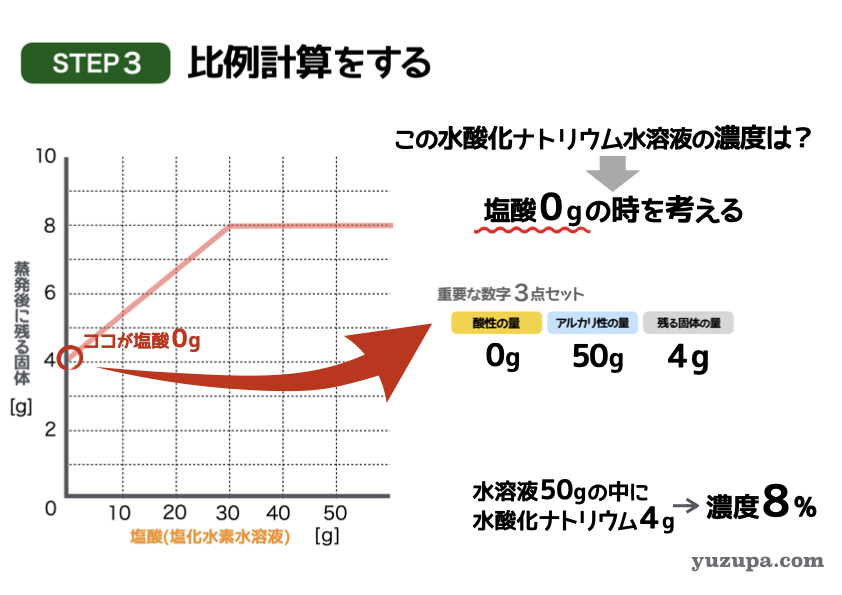
最後のステップで答えを計算します。
問題文ではこの水酸化ナトリウム水溶液の濃度を求めています。
えっ・・・濃度!?中和反応の問題じゃないの?
中和反応の問題に紛れて、たまにこういう問題がでますが・・・
中和で定番の 蒸発させて残る固体に着目 すれば解くことができます
混じり気のない 水酸化ナトリウム水溶液 の濃度が知りたいので
塩酸が0gのところに着目すれば良いわけです
このポイントを読み取ると・・・
塩酸の量= 0g、水酸化ナトリウム水溶液=50g、残る固体= 4 g
水酸化ナトリウム水溶液50gを蒸発させたら、水酸化ナトリウムが4gのこった。ということなので濃度は8%であることがわかりますd(^_^o)
念のため、式は以下ですd(^_^o)
水溶液の濃度 = 溶けているものの重さ ÷ 水溶液全体の重さ
= 4 g ÷ 50 g
= 0.08
答えは 8% です
まとめ
今回のテーマはみんな苦手な「中和反応」についてできるだけ分かりやすくまとめました。ポイントは基本的な7つの知識と、3つのステップで解くということ。表やグラフの読み取りがキーとなりますので練習をしましょうd(^_^o)
中和反応を理解する7つの基礎知識
① 中和とは 酸性+アルカリ性→中性
② 酸性とアルカリ性 3つのバランス
③ 水溶液を蒸発させると残るモノ
④ 中和反応 重要数字3点セット
⑤ 液体の混ぜ方 3つのパターン
⑥ 中和反応 3つのグラフと表
⑦ 性質を調べる5つの指示薬
中和反応を攻略する3つのステップ
STEP1 重要数字セットを読み取る
STEP2 完全中和の比を見きわめる
STEP3 比例計算で答えを出す!
苦手意識を抱きやすい中和反応も、落ち着いて必要な知識を習得し、型(かた)となる手順にしたがって取り組めば、攻略することができます。この知識と手順をおさえて練習問題を解いてみましょうd(^_^o)










